新晋诺奖得主Baker团队最新Cell| 从头设计小型口服IL-23和IL-17拮抗蛋白
发布日期:2024-12-24
发布者: 合肥科晶生物
这项研究于2024年8月8日在线发表于Cell。主要目标是开发出针对白细胞介素-23受体(IL-23R)和白细胞介素-17(IL-17)的口服小型拮抗蛋白(minibinders)。IL-23和IL-17是自身炎症性疾病的治疗靶点,已有抗体药物进入临床使用,但存在成本高、给药不便、持续疗效差等局限。
正如论文所述:
Antibodies targeting IL-23 and IL-17 have shown clinical efficacy but are limited by high costs, safety risks, lack of sustained efficacy, and poor patient convenience as they require parenteral administration.
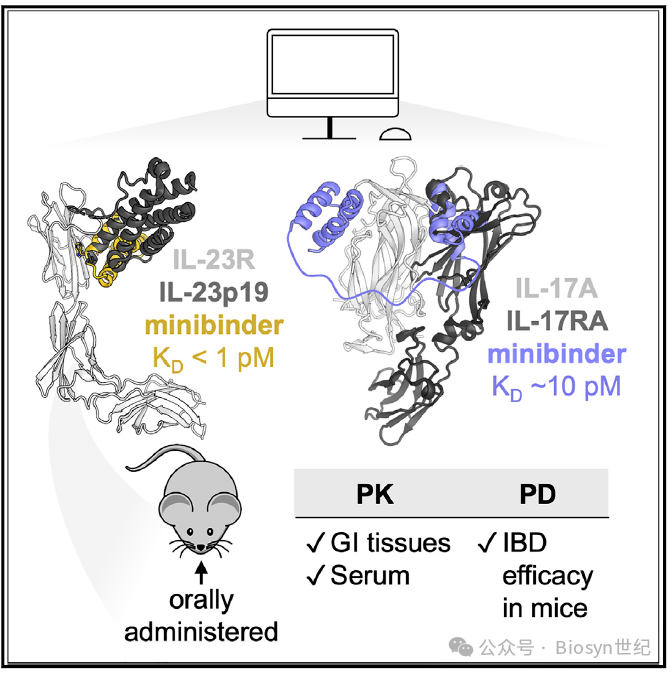
因此,研究人员希望开发出口服生物制剂,以改善患者的依从性和生活质量,降低医疗成本。这对于炎症性肠病(IBD)、银屑病等自身炎症性疾病的治疗有重要意义。作为一个万亿级别的市场,开发新型口服生物制剂有巨大的商业价值。
研究思路与方法创新
本研究采用了计算机辅助从头蛋白质设计的方法,从零开始设计出了亲和力极高(亚皮摩尔级)、稳定性极佳的IL-23R和IL-17小型结合蛋白(minibinders)。与传统抗体和多肽相比,这些人工设计蛋白具有以下特点:
分子量只有抗体的1/30,更易穿透肠黏膜屏障,在全身实现药物分布
在极端pH值、高温、蛋白酶消化等模拟胃肠道环境下具有超高稳定性
对靶点有极高的亲和力和特异性,体外和动物实验证实有良好的拮抗活性
可在大肠杆菌中简单表达生产,成本远低于哺乳动物细胞表达系统生产的抗体
实现上述特性主要得益于从头设计策略的应用。研究者以IL-23R-IL-23p19复合物和IL-17A-IL-17RA复合物的晶体结构为模板,计算筛选天然和人工热点残基,对接到计算优化的稳定scaffold上,进一步优化结合界面残基,最终得到初始的minibinder。随后通过饱和突变文库和定向进化,迭代优化minibinder的亲和力和稳定性,最终产生了极高性能的口服拮抗剂。

Figure 1. Computational design of IL-23R and IL-17A minibinders
整个过程体现了蛋白质设计"由计算机辅助设计-实验室优化-计算机指导优化"的反复迭代,相比于传统的理性设计和定向进化,大大提高了效率和成功率。这些都得益于近年来从头蛋白质设计技术的快速发展。
小型口服IL-23和IL-17拮抗蛋白的开发及应用
1. 从头设计出高亲和力、高稳定性的IL-23R和IL-17小型结合蛋白
研究者利用计算机辅助从头蛋白质设计技术,成功创制出了一系列针对IL-23受体(IL-23R)和IL-17的小型结合蛋白(minibinder),并通过定向进化实现了亲和力和稳定性的优化。
正如文中所述:
Computational design yielded low- and sub-pM minibinders of IL-17A and IL-23R
IL-23R minibinders are extremely resistant to heat, acid, and proteolysis
这些 minibinder 展现了极高的热稳定性、酸稳定性和蛋白酶稳定性(图2),有望克服口服给药的种种挑战。同时,它们对靶点具有极高的结合亲和力,优化后的 minibinder 23R-91与IL-23R的解离常数K D < 1 pM(图2B),17-53与IL-17A的K D 低至皮摩尔级(图3B)。
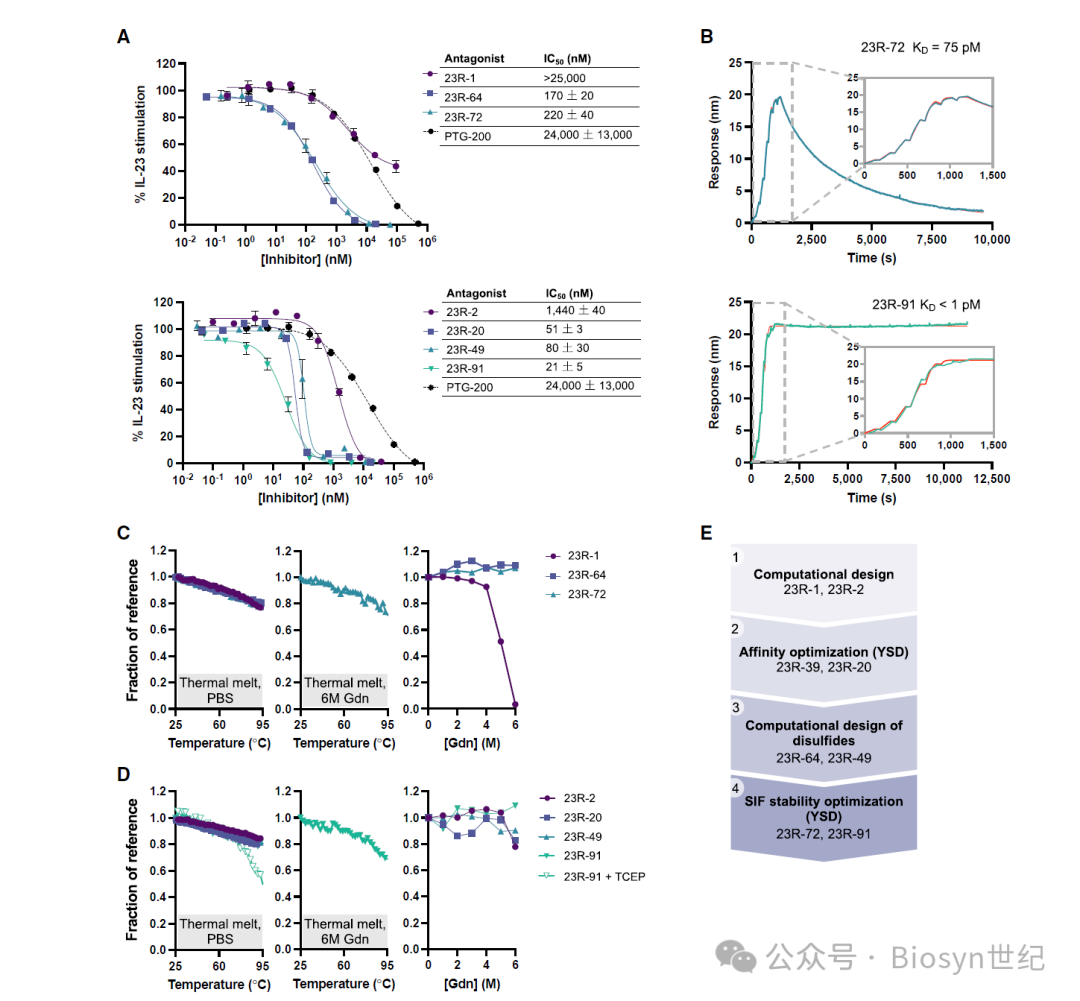
图2
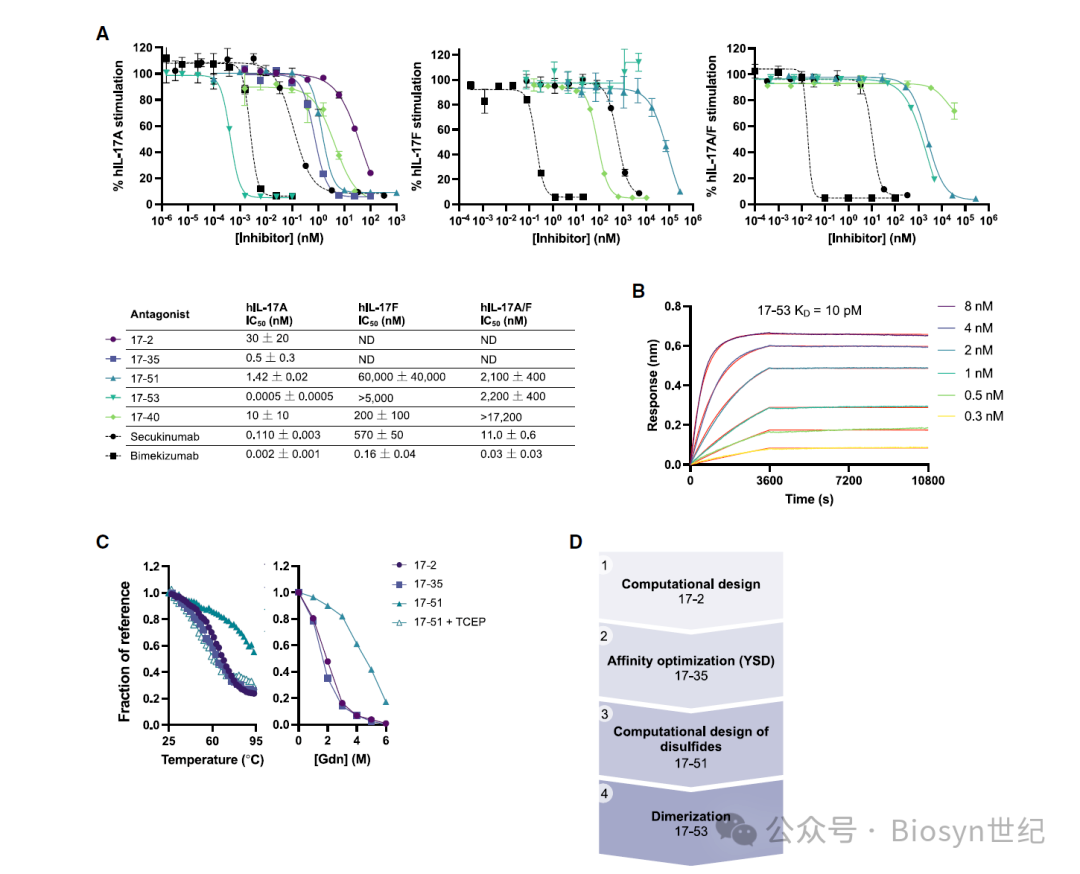
图3
2. 与临床抗体疗效相当甚至更优
研究中系统评估了这些 minibinder 在细胞和动物水平的药理活性。
体外实验表明,minibinder 能有效拮抗IL-23和IL-17诱导的信号通路激活和炎症因子表达。其中,23R-91拮抗IL-23的IC 50 为0.93 nM,优于临床抗体 guselkumab(图2A);17-53拮抗IL-17A的IC 50 为0.013 nM,是临床抗体 secukinumab 的200倍(图3A)。
在人源化小鼠结肠炎模型中,口服23R-91的疗效优于皮下注射临床抗体 guselkumab,在改善小鼠临床症状评分、结肠大体病理评分和组织学评分等方面达到统计学差异(图7):
Oral 23R-91 at both 8 and 80 mg/kg showed statistically significant improvement in disease scores compared with untreated control and a numerically greater improvement than i.p. guselkumab (Figure 7B).

图7
这些结果有力地支持了口服 minibinder 作为抗体替代疗法的可行性。
3. 口服给药后可在肠道局部和循环系统达到治疗浓度
研究在大鼠中评估了口服 minibinder 的药代动力学特征和生物分布情况。
给药后6小时,23R-72和23R-91在肠道组织可检测到40-200 nM的浓度,足以饱和IL-23R(图4C):
Minibinders were detected at 50–100 nM in the small intestinal contents and not in colon contents, and detected at higher concentrations in the small intestinal tissue (40–200 nM) than colon tissue (2–20 nM)
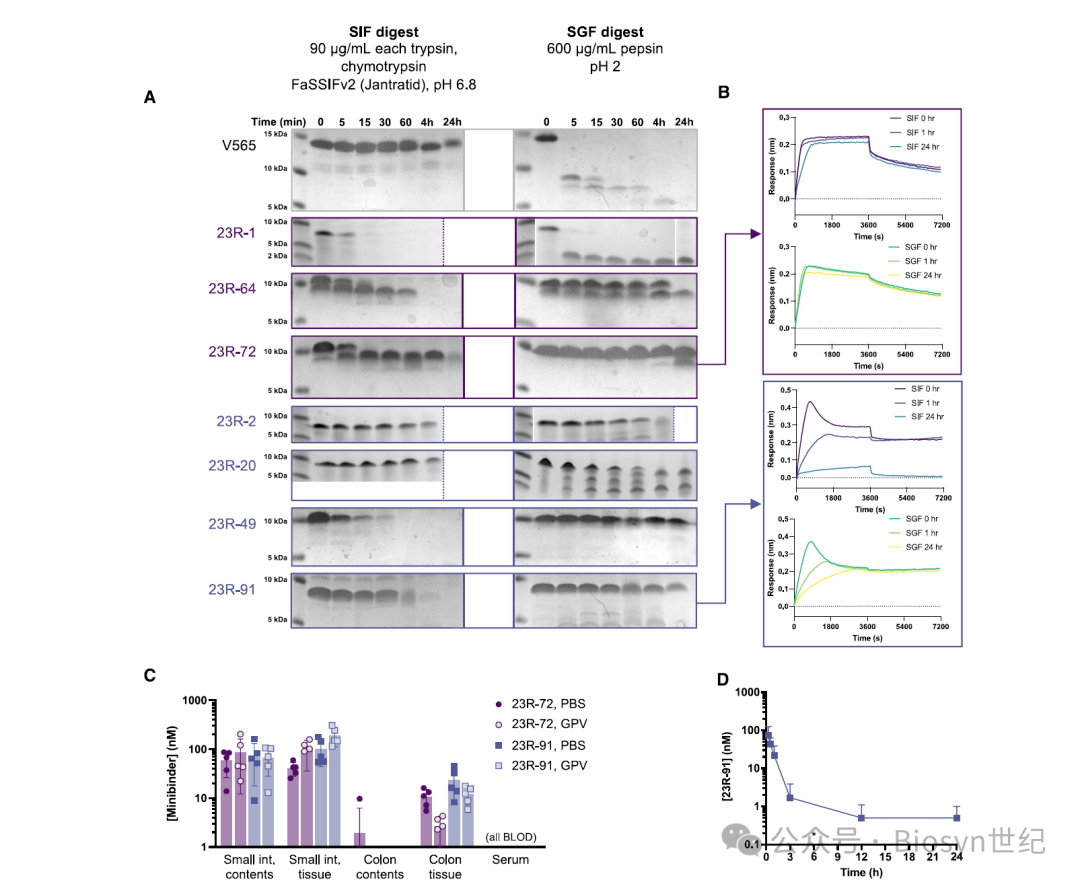
图4
口服140 mg/kg剂量后,在血清中的半衰期约15 min(图4D)。尽管全身暴露量低,但研究者推测 minibinder 极高的亲和力和很慢的解离速率有望实现IL-23R的持续抑制。
这些发现为确定 minibinder 的给药方案提供了关键的药代动力学参数,为将其开发为口服药物奠定了基础。
小结
综上所述,这项研究在口服蛋白药物开发领域取得了一系列突破:
证实了从头蛋白质设计和定向进化相结合,能创制出亲和力高、稳定性好的口服生物制剂;
在动物疾病模型中,口服 minibinder 的药效学和药代动力学特征优于注射给药的抗体;
为 minibinder 作为炎症性肠病等自身免疫性疾病的口服治疗剂提供了强有力的证据。
这些发现为开发新一代口服生物制剂提供了全新的研究思路和策略,有望显著改善患者依从性,提高生活质量,降低医疗成本。未来还需要开展进一步的临床前和临床试验,但这无疑代表了蛋白质药物研发领域的一个重要里程碑。
研究意义与商业价值
这项研究首次在动物模型中证实,口服小分子蛋白在自身炎症性疾病治疗中可以达到与抗体相当甚至更优的疗效。相比静脉或皮下注射给药,口服给药将极大地提高患者依从性,改善生活质量。此外,口服蛋白药物可采用微生物发酵生产,成本远低于抗体。
这些 minibinder 分子有望开发成新一代针对IBD、银屑病等自身炎症性疾病的口服生物制剂,对患者、医疗系统、制药企业都具有重要意义。从科研人员的角度,需要进一步开展临床前和临床研究,包括人体药代动力学、安全性、免疫原性的评估,制剂工艺的开发等。此外,类似策略还可以拓展到其他疾病的治疗,尤其是胃肠道疾病。这些都孕育着巨大的技术创新空间和投资机会。
未来研究方向与挑战
尽管这项研究取得了巨大突破,但口服蛋白药物要真正应用于临床,还面临许多科学和技术挑战,值得进一步探索:
人体内的药代动力学特征和口服生物利用度如何?能否通过给药剂型和给药方案的优化来提高?
长期、多次口服给药会否产生免疫原性?如何评估和应对免疫风险?
大规模生产工艺如何开发和优化?如何控制蛋白质的质量和成本?
这一技术平台能否拓展应用到更多疾病领域,成为新一代生物制剂的主流?

